Trong tự nhiên và đời sống hàng ngày, bạn có thể dễ dàng bắt gặp các vật liệu chứa silicat như kính, gốm sứ, xi măng hay thậm chí là trong một số sản phẩm mỹ phẩm. Nhưng silicat là gì, nó có cấu tạo ra sao và được ứng dụng như thế nào trong thực tế? Bài viết dưới đây Thủy tinh Pha lê Việt Tiệp sẽ giúp bạn hiểu rõ về hợp chất quan trọng này từ khía cạnh hóa học đến ứng dụng trong đời sống.
Silicat là gì?
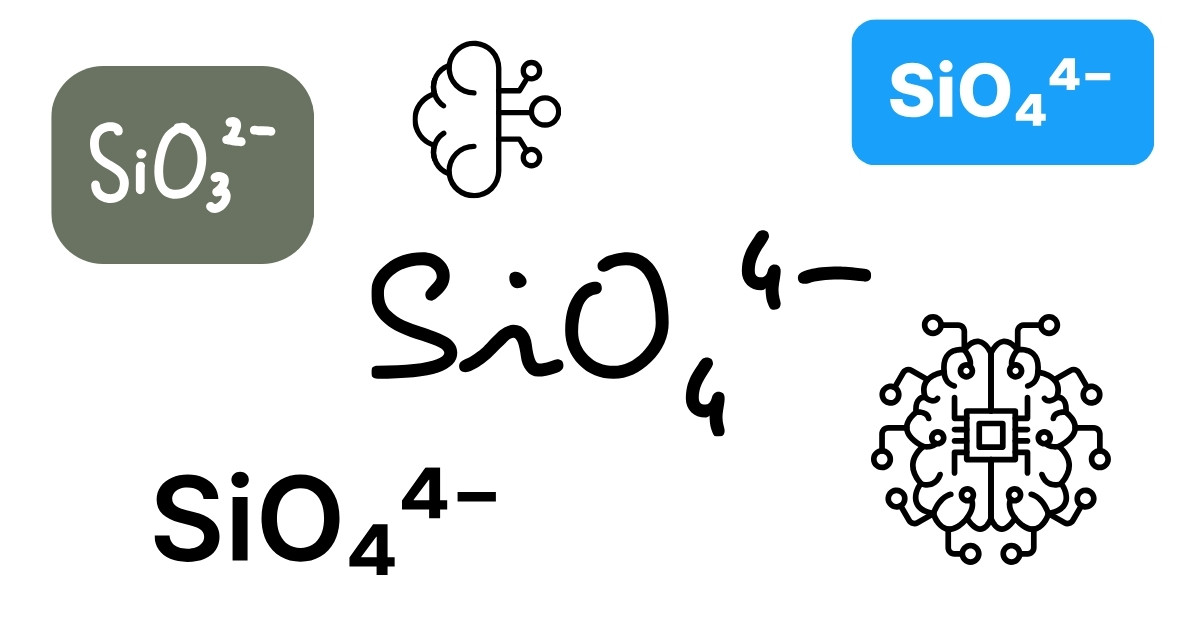
Silicat là tên gọi chung cho các hợp chất chứa ion silicat (SiO₄)⁴⁻ – đơn vị cấu trúc cơ bản gồm một nguyên tử silic (Si) liên kết với bốn nguyên tử oxy tạo thành hình tứ diện. Từ các tứ diện SiO₄⁴⁻ này, silicat có thể tạo thành hàng loạt khoáng chất khác nhau thông qua việc liên kết với nhau hoặc kết hợp với các kim loại như natri (Na), canxi (Ca), nhôm (Al), magie (Mg)…
Trong hóa học, silicat thuộc nhóm muối của axit silic, có thể tồn tại ở dạng đơn giản (ví dụ: Na₂SiO₃ – natri silicat) hoặc phức tạp như các khoáng vật silicat tự nhiên. Nhờ khả năng tạo mạng lưới bền vững, silicat là nền tảng của nhiều vật liệu quan trọng trong tự nhiên và công nghiệp.
Nguồn gốc và phân bố của silicat trong tự nhiên
Silicat là thành phần phong phú nhất của vỏ Trái Đất, chiếm tới hơn 90% tổng khối lượng khoáng vật. Chúng hình thành chủ yếu thông qua các quá trình địa chất như:
-
Kết tinh từ magma: Khi dung nham nguội lại, silicat kết tinh tạo thành các đá mácma như granite, basalt, diorite…
-
Biến chất địa chất: Nhiệt độ và áp suất cao làm biến đổi khoáng vật silicat, hình thành đá biến chất như gneiss, schist.
-
Phong hóa và lắng đọng: Silicat bị phân hủy, tái kết tủa và tích tụ thành các loại đất, đá trầm tích.
Các khoáng vật silicat phổ biến trong tự nhiên gồm:
-
Thạch anh (SiO₂)
-
Fenspat (NaAlSi₃O₈, KAlSi₃O₈)
-
Mica, olivin, pyroxen, amphibol – mỗi loại có cấu trúc liên kết SiO₄ khác nhau.

Cấu tạo và phân loại các hợp chất silicat
Silicat có cấu trúc phong phú nhờ khả năng liên kết linh hoạt giữa các đơn vị tứ diện SiO₄⁴⁻. Tùy theo kiểu liên kết, chúng được chia thành nhiều nhóm với đặc tính vật lý và ứng dụng khác nhau.
Cấu trúc tứ diện SiO₄
Tứ diện silicat là đơn vị cấu trúc cơ bản của tất cả các hợp chất silicat. Nó gồm một nguyên tử silic (Si) nằm ở trung tâm liên kết cộng hóa trị với bốn nguyên tử oxy (O) ở bốn đỉnh, tạo thành hình tứ diện đều.
Mỗi tứ diện SiO₄⁴⁻ có thể tồn tại riêng biệt hoặc liên kết với các tứ diện khác thông qua nguyên tử oxy, tạo nên các chuỗi, vòng, lớp hoặc mạng không gian ba chiều – đây chính là cơ sở cho sự phân loại silicat.
Phân loại theo cấu trúc liên kết (đơn, đôi, vòng, chuỗi, lớp, khung)
Dựa vào cách các tứ diện SiO₄ liên kết với nhau, silicat được chia thành 6 nhóm chính:
-
Silicat đơn (nesosilicates): Mỗi tứ diện tồn tại độc lập, không chia sẻ nguyên tử oxy với tứ diện khác (ví dụ: olivin).
-
Silicat đôi (sorosilicates): Hai tứ diện liên kết với nhau bằng một nguyên tử oxy chung (ví dụ: hemimorphite).
-
Silicat vòng (cyclosilicates): Các tứ diện liên kết thành vòng, thường có 3, 4 hoặc 6 tứ diện (ví dụ: beryl – vòng 6).
-
Silicat chuỗi (inosilicates): Gồm chuỗi đơn (pyroxen) hoặc chuỗi kép (amphibol), mỗi tứ diện chia sẻ 2 hoặc 3 nguyên tử oxy.
-
Silicat lớp (phyllosilicates): Tứ diện tạo thành các lớp phẳng song song, phổ biến trong đất sét và mica.
-
Silicat khung (tectosilicates): Mỗi tứ diện liên kết với 4 tứ diện khác qua các đỉnh, tạo mạng lưới không gian 3 chiều (ví dụ: thạch anh, fenspat).
Tính chất vật lý và hóa học của silicat
Các hợp chất silicat sở hữu nhiều tính chất nổi bật về mặt vật lý và hóa học, giúp chúng trở thành vật liệu lý tưởng trong tự nhiên cũng như trong sản xuất công nghiệp. Dưới đây là những đặc điểm quan trọng:
Tính tan, độ cứng và màu sắc
-
Tính tan: Phần lớn các silicat không tan trong nước, ngoại trừ một vài loại như natri silicat (Na₂SiO₃) có thể tan và tạo thành dung dịch kiềm.
-
Độ cứng: Tùy theo cấu trúc, độ cứng của silicat dao động khá lớn. Ví dụ:
-
Thạch anh (SiO₂) có độ cứng 7/10 trên thang Mohs.
-
Mica hoặc talc (silicat lớp) có độ cứng thấp hơn, dễ tách lớp.
-
-
Màu sắc: Silicat tinh khiết thường không màu hoặc trắng, nhưng nếu chứa tạp chất kim loại như sắt, đồng, mangan…, chúng có thể có màu xanh, hồng, nâu, đen…
Tính bền nhiệt và phản ứng hóa học đặc trưng
-
Chịu nhiệt tốt: Nhiều loại silicat có khả năng chịu nhiệt độ rất cao, không bị phân hủy dưới điều kiện thông thường – là vật liệu lý tưởng cho các sản phẩm chịu lửa, nồi nấu kim loại, gạch chống cháy.
-
Ít phản ứng hóa học: Silicat không phản ứng với hầu hết axit (trừ axit flohydric – HF có thể phá vỡ cấu trúc SiO₂).
-
Tạo dung dịch keo: Một số silicat kiềm như Na₂SiO₃ có thể phản ứng với nước tạo dung dịch keo, ứng dụng trong xử lý nước và làm keo dán thủy tinh.

Ứng dụng của silicat trong đời sống và sản xuất
Nhờ đặc tính bền nhiệt, không tan, ổn định hóa học và cấu trúc linh hoạt, silicat được ứng dụng rộng rãi trong nhiều lĩnh vực công nghiệp và sinh hoạt hàng ngày.
Trong công nghiệp xây dựng (xi măng, gốm sứ, thủy tinh)
-
Silicat là thành phần chính trong xi măng pooclăng, giúp tạo liên kết bền chắc giữa các vật liệu xây dựng.
-
Dùng để sản xuất gạch chịu lửa, ngói, men sứ, vật liệu lát nền và tường.
-
Thủy tinh silicat được sử dụng phổ biến trong sản xuất ly, chai lọ, kính xây dựng và kính chịu lực.
Trong hóa mỹ phẩm và chất tẩy rửa
-
Natri silicat được dùng làm chất ổn định, làm mềm nước trong xà phòng và bột giặt.
-
Một số silicat dạng bột mịn được sử dụng trong kem đánh răng, phấn nền, mặt nạ đất sét, giúp làm sạch và hấp thụ dầu.
-
Có tác dụng làm đục hoặc tạo độ sệt trong các công thức mỹ phẩm.
Trong nông nghiệp và xử lý nước
-
Silicat giúp cây trồng cứng cáp, chống sâu bệnh và giảm hấp thụ kim loại nặng trong đất.
-
Dùng trong phân bón khoáng, cải tạo đất và tăng độ kiềm nhẹ cho môi trường đất.
-
Trong xử lý nước, một số silicat hoạt tính giúp kết tủa tạp chất, hấp phụ ion kim loại nặng và chất hữu cơ.

Một số hợp chất silicat tiêu biểu
Các hợp chất silicat tồn tại dưới nhiều dạng, trong đó một số có tính ứng dụng cao trong công nghiệp và đời sống:
Natri silicat (Na₂SiO₃)
-
Còn gọi là thủy tinh lỏng, tan được trong nước, tạo dung dịch kiềm.
-
Ứng dụng:
-
Làm keo dán thủy tinh, chất chống cháy, xi măng chịu nhiệt.
-
Xử lý nước thải, làm chất tẩy rửa công nghiệp.
-
Canxi silicat (CaSiO₃)
-
Là thành phần chính trong xi măng, vật liệu cách nhiệt, gạch chịu lửa.
-
Có khả năng chịu nhiệt và cách âm tốt, thường dùng trong xây dựng và công nghiệp luyện kim.
Nhôm silicat (Al₂SiO₅)
-
Xuất hiện dưới ba dạng khoáng vật: andalusite, kyanite, sillimanite.
-
Ứng dụng:
-
Trong sản xuất gốm sứ kỹ thuật, vật liệu chịu nhiệt và cách điện.
-
Là chất độn trong cao su, sơn và nhựa để tăng độ bền và giảm chi phí.
-

Câu hỏi thường gặp về silicat
Silicat là hợp chất phổ biến trong tự nhiên và được ứng dụng rộng rãi trong đời sống. Tuy nhiên, nhiều người vẫn còn băn khoăn về tính an toàn và sự khác biệt của nó so với các hợp chất liên quan. Dưới đây là những câu hỏi thường gặp:
Silicat có độc không?
Phần lớn các dạng silicat là an toàn và không gây độc khi sử dụng trong sản phẩm tiêu dùng, vật liệu xây dựng hay mỹ phẩm. Tuy nhiên, một số dạng hạt mịn của silicat (đặc biệt là silica tinh thể – SiO₂) nếu bị hít phải trong thời gian dài có thể gây bệnh bụi phổi (silicosis) hoặc ảnh hưởng đến hệ hô hấp. Do đó, trong môi trường sản xuất hoặc khai thác khoáng silicat, cần trang bị bảo hộ lao động đầy đủ.
Silicat và silica có giống nhau không?
Không hoàn toàn giống nhau.
-
Silica (SiO₂): là dạng tinh khiết nhất của silic, thường gặp trong thạch anh, cát, đá lửa.
-
Silicat: là hợp chất gồm ion silicat (SiO₄⁴⁻) kết hợp với các kim loại như Na, Ca, Al… tạo nên các khoáng vật phức tạp hơn. Nói cách khác, silica là một dạng đặc biệt và đơn giản hơn của silicat.
Có nên sử dụng silicat trong sản phẩm tiêu dùng?
Có. Silicat được sử dụng an toàn trong nhiều sản phẩm tiêu dùng như:
-
Kem đánh răng, mỹ phẩm, phấn phủ – giúp hấp thụ dầu và tạo kết cấu mịn.
-
Thủy tinh, gốm sứ, bột giặt – nhờ tính ổn định và không phản ứng với các chất thông thường. Miễn là sản phẩm có nguồn gốc rõ ràng và tuân thủ quy chuẩn an toàn, silicat hoàn toàn phù hợp để sử dụng hàng ngày.

Hiểu rõ silicat là gì không chỉ giúp bạn nắm vững kiến thức hóa học mà còn nhận thức được vai trò thiết yếu của nó trong đời sống hiện đại – từ vật liệu xây dựng đến sản phẩm chăm sóc cá nhân. Với đặc tính bền, đẹp, ổn định và thân thiện với môi trường, silicat xứng đáng là một trong những hợp chất quan trọng nhất trong tự nhiên và công nghiệp.
LIÊN HỆ TƯ VẤN
Để nhận chiết khấu ưu đãi quý khách vui lòng liên hệ trực tiếp với Thủy tinh Pha lê Việt Tiệp thông qua các cách sau:
- Website: www.phaleviettiep.com
- Zalo OA: Thủy tinh pha lê Việt Tiệp
- Fanpage: Thủy tinh pha lê Việt Tiệp
- Fanpage: Fanpage Lotus Glass
- Hotline: +84 1800 6639
- Email: cskh@phaleviettiep.com




